Berandasehat.id – Administrasi Obat dan Makanan AS (FDA) telah menyetujui biosimilar insulin kerja cepat baru untuk membantu mengelola gula darah pada penderita diabetes, termasuk anak-anak dan orang dewasa.
Produk yang disebut Merilog, adalah biosimilar insulin kerja cepat pertama yang mendapatkan persetujuan federal. Biosimilar adalah versi yang hampir identik dari obat biologis yang disetujui FDA, yang menawarkan keamanan dan efektivitas yang sama.
Diabetes adalah kondisi ketika kadar gula darah (atau glukosa) menjadi terlalu tinggi karena tubuh tidak dapat membuat atau menggunakan insulin dengan benar. Insulin, yang dibuat oleh pankreas, membantu memindahkan gula ke dalam sel untuk energi. Tanpa insulin yang cukup, gula darah menumpuk, yang menyebabkan masalah kesehatan.
Di Amerika Serikat saja tercatat lebih dari 38 juta orang menderita diabetes, dan sekitar 8,4 juta bergantung pada insulin untuk mengelola gula darahnya.
Dengan meningkatnya kebutuhan insulin, pilihan biosimilar dapat membuat perawatan yang menyelamatkan nyawa ini lebih mudah diakses. Merilog, yang dibuat oleh Sanofi-Aventis, adalah biosimilar insulin kerja cepat (mirip dengan Novolog dari Novo Nordisk) yang membantu mengendalikan lonjakan gula darah jika diminum lima hingga 10 menit sebelum makan.
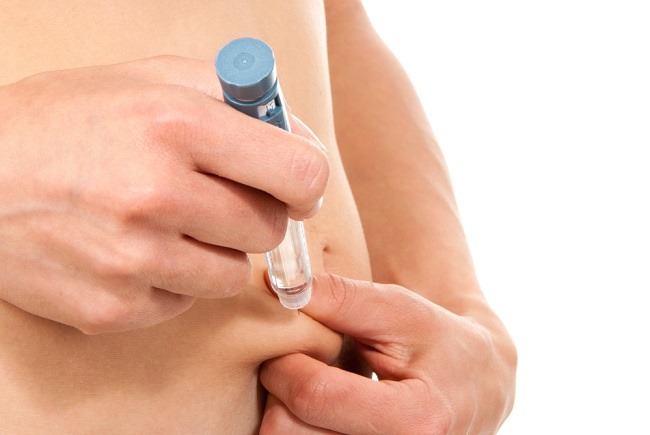
Merilog disuntikkan di bawah kulit, biasanya di perut, paha, bokong, atau lengan atas. Dosisnya harus disesuaikan dengan kebutuhan pasien, kata FDA.
Efek samping umum Merilog meliputi reaksi kulit atau perubahan tekstur kulit di tempat jarum masuk ke kulit, gatal, ruam, penambahan berat badan, dan pembengkakan di tangan dan kaki.
Obat ini juga dapat menyebabkan efek samping serius seperti kadar gula darah dan kalium rendah serta alergi parah, demikian laporan WebMD. (BS)
